闽食药监通告〔2018〕14号
为贯彻落实《国务院关于在更大范围推进“证照分离”改革试点工作的意见》(国发〔2017〕45 号)和原国家食品药品监督管理总局《关于在更大范围试点实施进口非特殊用途化妆品备案管理有关事宜的公告》(2018 年第 31 号)等文件精神,现将在中国(福建)自由贸易试验区(以下简称“福建自贸试验区”)内开展进口非特殊用途化妆品备案管理试点工作的有关事项通告如下:
一、自公告发布之日起至 2018 年 12 月 21 日,从福建自贸试验区口岸进口、且境内责任人注册地在福建自贸试验区的首次进口非特殊用途化妆品,试点实施审批管理调整为备案管理。
二、试点范围内的进口非特殊用途化妆品生产企业及其境内责任人应当在产品进口前按要求办理首次进口非特殊用途化妆品备案手续,取得备案凭证后方可开展进口贸易(有关办事指南详见附件)。
三、为方便企业办理备案事项,在福建自贸试验区福州、厦门、平潭三个片区分别设立受理窗口,办理境内责任人备案系统用户名称和初始密码发放、用户注册纸质资料和备案纸质资料接收等相关事宜。
(一)注册地址在福州片区的境内责任人申请受理地点:福州市鼓楼区温泉公园路69号市行政服务中心一层
(二)注册地址在厦门片区的境内责任人申请受理地点:厦门市象屿路93号厦门国际航运中心C区二层
(三)注册地址在平潭片区的境内责任人申请受理地点:平潭金井湾商务营运中心7号楼一层行政服务中心
四、产品备案后,境内责任人持进口非特殊用途化妆品备案管理系统生成的产品备案凭证及盖有所在地监管部门业务受理专用章的产品备案材料接收回执等相关资料,到海关部门按照有关规定办理进口手续,并从注册地对应的自贸区口岸进口经备案的化妆品。
五、已备案产品后续需要从注册地以外的其他口岸进口时,应当注销已备案产品信息,按照《化妆品卫生监督条例》规定,申请化妆品首次进口行政许可获得批准后方可进口,或者从进口口岸所在自贸试验区重新办理备案手续,取得备案凭证后方可进口。
六、境内责任人应履行承诺,建立进口非特殊用途化妆品质量安全管理制度,加强产品质量追溯管理,承担产品的质量安全责任,确保化妆品的进口和经营符合法规和标准的要求,发生产品质量安全问题时,应主动公开相关信息并及时召回。
特此通告。
附件:进口非特殊用途化妆品备案办事指南及附录(表格)
福建省食品药品监督管理局 中国(福建)自由贸易试验区工作领导小组办公室
中华人民共和国福州海关 中华人民共和国厦门海关
2018 年 5月31日
附件
进口非特殊用途化妆品备案办事指南
一、适用范围
本指南适用于福建自贸试验区福州、厦门、平潭片区口岸进口的非特殊用途化妆品备案的申请与办理。
二、事项名称
进口非特殊用途化妆品备案
分项名称:首次备案 、备案变更、备案注销
三、办理依据
(一)《国务院关于在更大范围推进“证照分离”改革试点工作的意见》(国发〔2017〕45号)
(二)原国家食品药品监管总局《关于在更大范围试点实施进口非特殊用途化妆品备案管理有关事宜的公告》(2018年第31号)
(三)原国家食品药品监管总局办公厅《关于通报进口非特殊用途化妆品备案凭证调整有关情况的函》(食药监办药化管函〔2018〕164号)
四、办理机构
(一)办理机构名称及权限
福建省食品药品监督管理局负责备案管理
(二)资料审查内容
备案产品是否属于备案范围、备案资料是否完整、备案资料是否符合规定形式等。
(三)法律效力
符合备案要求的,予以备案。境内责任人可持进口非特殊用途化妆品备案信息系统生成的产品备案信息凭证以及盖有所在地监管部门业务受理专用章的产品备案材料接收回执等相关资料,至海关部门按照规定办理进口相关手续。产品备案信息在原国家食品药品监督管理总局进口非特殊用途化妆品备案信息系统(http://ft.zybh.gov.cn/province/webquery/list.jsp)上公布。福建省食品药品监督管理局在产品备案后3个月内组织开展对备案资料的监督检查。
五、备案对象
从福建自贸试验区口岸进口的首次进口非特殊用途化妆品。
境外化妆品生产企业授权的、注册地在福建自贸试验区的企业法人作为境内责任人,申请首次进口非特殊用途化妆品备案之前,应当先通过备案管理系统报送以下资料进行用户注册(http://ft.zybh.gov.cn/enterprise/index.jsp)。
(一)加盖境内责任人公章,并由其责任人签字的进口非特殊用途化妆品备案管理系统用户名称注册申请书;
(二)境外生产企业对境内责任人的授权书及其公证件,授权书为外文的,还应译成中文,并对翻译件与原件一致进行公证;
(三)境内责任人营业执照。
系统审核通过后,境内责任人应持与上述注册电子资料一致的纸质资料到福建自贸试验区福州、厦门、平潭片区对应的进口非特殊用途化妆品备案受理窗口,领取境内责任人备案系统用户名称和初始密码,办理用户注册纸质资料和备案纸质资料接收等相关事宜。
六、备案条件
(一)首次备案
1.产品属于备案范围;
2.备案资料完整;
3.备案资料符合规定形式;
4.备案资料电子版与纸质版一致。
(二)备案变更
已取得备案信息凭证的进口非特殊用途化妆品办理相关信息(产品的配方除外)的变更
(三)备案注销
已备案产品不再从注册的福建自贸试验区福州、厦门、平潭片区进口
七、备案数量
无备案数量限制
八、申请材料
(一)备案申请材料目录及要求
|
序号 |
提交材料名称 |
要求 |
|
1 |
进口非特殊用途化妆品备案申请表 |
申请表在线填报后打印纸质申请表,并按要求签名、盖章。内容应完整、清楚,不得涂改 |
|
2 |
产品中文名称命名依据 |
产品中文名称应当符合《化妆品命名规定》、《化妆品命名指南》的要求。 1)命名依据中应提供申报产品的商标名、通用名(含使用目的或使用部位)、属性名具体含义的解释。约定俗成的、习惯使用的化妆品名称可省略通用名、属性名。 2)产品中文名称中若有表明产品物理性状或外观形态以及含颜色、色号、气味、适用发质、肤质或特定人群等内容的,应加以解释。 3)产品中文名称中若使用具体原料名称或表明原料类别词汇的,应加以解释。 4)产品中文名称中的修饰、形容词或必须使用外文字母、符号等的,应加以解释。 5)需标注产品中文名称的汉语拼音名。 |
|
3 |
产品配方 |
产品配方要求参照《关于印发化妆品行政许可申报受理规定的通知》(国食药监许〔2009〕856号)附件《化妆品行政许可申报资料要求》第十四条、第二十六条执行。 |
|
4 |
产品质量安全控制要求 |
应包括在原产国执行的产品质量安全控制要求(外文版及中文译文)及产品符合《化妆品安全技术规范》(2015年版)要求的承诺。 |
|
5 |
产品包装图片 |
产品原包装(含产品标签、产品说明书)图片;拟专为中国市场设计包装的,需同时提交产品设计包装(含产品标签、产品说明书)。 |
|
6 |
产品生产工艺简述 |
提供的生产工艺简述应包括工艺流程简图,工艺简述应能简明扼要地反映产品的实际生产过程,包括操作步骤、各步骤中涉及的原料等。产品配方中所有原料应在生产工艺中列出,原料名称应与产品配方一致。工艺简述应与工艺简图相符。 |
|
7 |
产品技术要求 |
参照《关于印发化妆品产品技术要求规范的通知》(国食药监许〔2010〕454号)要求编制。 |
|
8 |
化妆品行政许可检验机构出具的检验报告及相关资料 |
1)产品检验要求参照《关于印发化妆品行政许可检验管理办法的通知》(国食药监许〔2010〕82号)执行。 2)检验报告要求参照《关于印发化妆品行政许可申报受理规定的通知》(国食药监许〔2009〕856号)附件《化妆品行政许可申报资料要求》第十八条执行。 |
|
9 |
产品中可能存在安全性风险物质的有关安全性评估资料 |
参照《化妆品中可能存在的安全性风险物质风险评估指南》(国食药监许〔2010〕339号)执行。 |
|
10 |
化妆品使用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书 |
参照原卫生部卫生监督中心《关于要求对进口化妆品提交承诺书的公告》执行。 |
|
11 |
产品在生产国(地区)或原产国(地区)生产和销售的证明文件 |
生产和销售证明文件要求参照《关于印发化妆品行政许可申报受理规定的通知》(国食药监许〔2009〕856号)附件《化妆品行政许可申报资料要求》第二十一条、第二十四条执行。 |
|
12 |
境外生产企业生产质量管理的相关证明材料 |
相关证明材料包括质量管理体系或良好生产规范的证明文件或符合生产企业所在国(地区)法规要求的化妆品生产资质的证明文件。证明文件应由认证机构或第三方出具或认可。无法提交原件的,可提交复印件,复印件应由中国公证机关公证或由我国使(领)馆确认;所载明的生产企业名称和地址应与所申报的内容完全一致。 |
|
13 |
有助于备案的其他资料 |
参照《化妆品行政许可申报受理规定》(国食药监许〔2009〕856号,可能有助于备案的其他资料。 |
注:查询以上法规规范性文件可登陆原国家食品药品监督管理局网站化妆品一栏,进行站内搜索(http://samr.cfda.gov.cn/WS01/CL1028/)。
(二)形式标准
电子版备案资料通过原国家食品药品监督管理总局进口非特殊用途化妆品备案信息系统递交,提交的材料须符合系统说明的相关要求。
纸质备案资料提交至境内责任人注册地所在的进口非特殊用途化妆品备案受理窗口,提交的材料须符合下列要求:
1.除检验报告、公证文书、官方证明文件及第三方证明文件外,申报资料原件应由境内责任人逐页加盖公章或骑缝章。
2.使用A4规格纸张打印,使用明显区分标志,按规定顺序排列,并装订成册。
3.使用中国法定计量单位。
4.申报内容应完整、清楚,同一项目的填写应当一致。
5.所有外文(境外地址、网址、注册商标、专利名称等必须使用外文的除外)均应译为规范的中文,并将译文附在相应的外文资料前。
6.终止申报后再次申报的,还应说明终止申报及再次申报的理由;不予备案后再次申报的,应提交不予备案决定书复印件,并说明再次申报的理由,同时还应提交不予备案原因是否涉及产品安全性的书面说明。
7.生产和销售证明文件、质量管理体系或良好生产规范的证明文件、不同国家的生产企业同属一个集团公司的证明、委托加工协议等证明文件可同时列明多个产品。这些产品如同时申报,一个产品使用原件,其他产品可使用复印件,并书面说明原件所在的申报产品名称;这些产品如不同时申报,一个产品使用原件,其他产品需使用经公证后的复印件,并书面说明原件所在的申报产品名称。
(三)申请文书名称
《进口非特殊用途化妆品备案申请表》,在线填写后打印。
九、办结时限
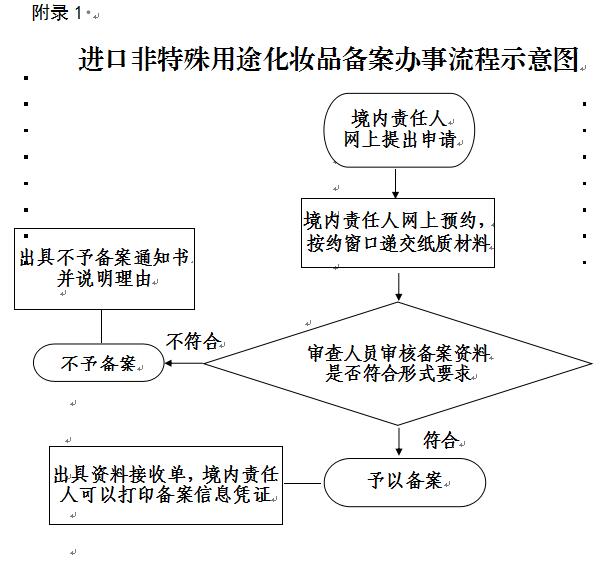
境内责任人根据网上预约时间,持与电子版一致的纸质版资料及委托书等资料至受理窗口办理备案。收到产品备案资料(含纸质及电子版资料)后,监管部门对产品是否属于备案范围、备案资料是否完整、备案资料是否符合规定形式以及电子版与纸质版是否一致等方面进行核对。经核对,符合要求的,当场接收备案资料,给予《备案材料接收回执》,予以备案。不符合要求的,给予《备案材料不予接收告知书》并说明理由。
十、备案信息凭证
《进口非特殊用途化妆品备案信息凭证》,备案后自行下载、打印。
十一、收费依据及标准
本备案项目不收费
十二、申请接收
(一)接收方式
1.电子版备案资料由原国家食品药品监督管理总局进口非特殊用途化妆品备案信息系统接收。境内责任人应当按照本办事指南的要求办理备案系统用户名注册,领取备案系统用户名称和初始密码后,在原国家食品药品监督管理总局政务网站(网址:http://ft.zybh.gov.cn/enterprise/index.jsp)提交电子备案资料。
2.受理窗口和接收时间
纸质备案资料由福建省食品药品监督管理局在福建自贸试验区福州、厦门、平潭片区设立的进口非特殊用途化妆品备案受理窗口接收。
境内责任人应从注册的福建自贸试验区福州、厦门、平潭片区对应的受理窗口递交纸质备案资料。
福州自贸片区受理地址:福州市鼓楼区温泉公园路69号市行政服务中心一层市场监管局152窗口
接收时间:周一至周五(节假日除外)
上午:9:00-12:00,下午:13:00-17:00(夏季时调整为上午:9:00-12:00,下午:14:00-17:30)
电 话:0591-83215774
厦门自贸片区受理地址:厦门市象屿路93号厦门国际航运中心C区二层3号窗口
接收时间:周一至周五 (节假日除外)
上午9:00-12:00,下午13:00-17:00
电话:0592-2656629
平潭自贸片区受理地址:平潭金井湾商务营运中心7号楼一层行政服务中心13号窗口
接收时间:周一至周五(节假日除外)
上午8:15-12:00,下午14:00-17:30
电话:0591-23162030
十三、办理方式
(一)备案
1.办理环节:申请、接收、审核、复核、确认
2.审查方式:网上审查
3.适用情形:适用于首次进口非特殊用途化妆品备案
(二)备案变更
1.办理环节:申请、接收、审核、复核、确认
2.审查方式:网上审查
3.适用情形:适用于进口非特殊用途化妆品备案后信息变更(产品配方除外)
(三)备案注销
1.办理环节:申请、接收、审核、复核、确认
2.审查方式:网上审查
3.适用情形:适用于拟不再从福建自贸试验区注册的口岸进口的非特殊用途化妆品,注销产品备案。
(四)备案资料的监督检查
福建省食品药品监管部门在产品备案后3个月内,组织开展对备案资料的监督检查。重点检查产品配方、生产工艺、检验项目、安全性风险评估等是否符合安全性相关要求,必要时进行现场监督检查。
根据检查情况,对符合要求予以确认;对发现备案材料存在不符合要求的,将通过进口非特殊用途化妆品备案管理系统通知境内责任人提交相关补充资料、暂停进口销售;对发现存在违法情形或产品质量安全问题的,依法予以查处。
十四、结果查询
产品备案信息(备案基本信息、产品技术要求、产品中文标签、产品上市包装立体图、产品原包装平面图等)和产品备案资料监督检查结果在原国家食品药品监管总局政务网站,进口非特殊用途化妆品备案服务平台公布。
查询网址:http://ft.zybh.gov.cn/province/webquery/list.jsp
十五、办事流程示意图 (见附录1)
十六、进口非特殊用途化妆品备案管理系统企业用户名称注册申请书(式样)(见附录2)
十七、进口非特殊用途化妆品备案境内责任人授权书(式样)(见附录3)
附录1
附录2
进口非特殊用途化妆品备案管理系统企业用户名称注册申请书(式样)
根据《国家食品药品监督管理总局关于在更大范围试点实施 进口非特殊用途化妆品备案管理有关事宜的公告(2018 年第31 号)要求,我企业现申请开通进口非特殊用途化妆品备案管理系 统企业用户账号,请予批准。在此作出以下郑重声明:
一、承诺所填报信息和提交的证明材料真实、完整。如有不实之处,我企业将承担相应法律责任及由此造成的一切后果。
二、我企业作为××××××(授权方名称)×××××××(授权范围)的进口非特殊用途化妆品备案境内责任人,承诺对我企业备案的进口非特殊用途化妆品承担质量安全责任。如产品存在质量安全问题,我企业将承担相应法律责任及由此造成的一切后果。
企业名称(签章)
法定代表人(签字)
年 月 日
附录3
进口非特殊用途化妆品备案境内责任人授权书(式样)
经双方协商一致,现就进口非特殊用途化妆品备案境内责任人授权有关事宜明确如下:
授权方:
被授权方:
授权范围:
授权时限:
授权方(签章): 被授权方(签章):
负责人(签字): 法定代表人(签字):
地址: 地址:
联系方式: 联系方式:
年 月 日 年 月 日
扫一扫在手机上查看当前页面




